پيوندهاي شيميايي
مي دانيم اتم ها اجزاي سازنده ي تمام مواد هستند و از طريق پيوندهاي شيميايي ناشي از نيروهاي جاذبه ي قوي که بين آن ها وجود دارد، به هم ديگر اتصال پيدا مي کنند. اما دقيقاً يک پيوند شيميايي چيست؟
ناحيه اي که هنگام برهم کنش الکترون هاي اتم هاي مختلف با يکديگر ايجاد مي شود، پيوند شيميايي ناميده مي شود. الکترون هايي که در پيوند شيميايي شرکت مي کنند، الکترون هاي ظرفيت ناميده مي شوند که در خارجي ترين پوسته اتم يافت مي شوند.
زماني که دو اتم به هم ديگر نزديک مي شوند، الکترون هاي خارجي ترين لايه ي هر دو با هم اندرکنش مي کنند. با اين که الکترون ها هم ديگر را دفع مي کنند،اما باعث جذب پروتون هاي درون اتم مقابل خود مي شوند. اثر متقابل نيروها در اتم ها باعث تشکيل پيوند بين آن ها و اتصالشان به هم ديگر خواهد شد.
همان گونه که از اطلاعات اوليه ي شيمي مي دانيم، عناصر گازي بي اثر گروه 8 به صورت گازهاي تک اتمي وجود دارند و در حالت کلي با ديگر عناصر واکنش نمي دهند. در مقابل، ديگر عناصر گازي به صورت مولکول هاي دو اتمي وجود دارند (H2, N2, O2, F2, Cl2) و همگي به جز نيتروژن، واکنش پذير هستند. واکنش پذيري اين عناصر در معادلات زير نشان داده شده است:
2Na + Cl2 ........ 2NaCl
2H2 + O2 ......... 2H2O
C + O2 .......... CO2
C + 2F2 .......... CF4
اکنون سؤال اين است که چرا اتم هاي بسياري از عناصر با هم واکنش نشان مي دهند تا مولکول هاي پايداري به وجود آورند؟
براي پاسخ به اين سؤال، ابتدا بهتر است با يک مدل بسيار ساده براي جذب يا پيوند اتم ها به يکديگر شروع کنيم و سپس به توضيحات سطح بالا برسيم.
دو نوع اصلي پيوند بين اتم ها، پيوند يوني و کوالانسي است. اما انواع ديگر پيوند هم وجود دارد.
پيوند يوني:
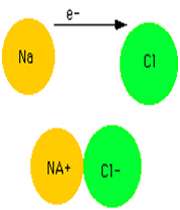
يک پيوند يوني زماني تشکيل مي شود که اتمي، يک يا چند الکترون ظرفيت خود را به اتم ديگري ببخشد يا همين الکترون ها را از اين اتم بپذيرد.
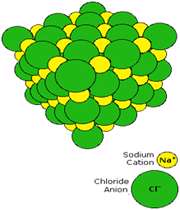
به عنوان مثال، زماني که سديم در محيطي که داراي گاز کلر است، سوزانده شود، ترکيب سديم کلرايد توليد مي کند(معادله ي اول). اين ترکيب، نقطه ي ذوب بالايي دارد (800° C) و در آب حل مي شود تا يک محلول رسانا حاصل کند.
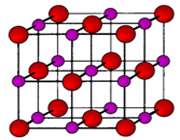
سديم کلرايد يک ترکيب يوني است. در شکل 1 (الف و ب)،تشکيل پيوند سديم کلرايد و نوع پيوند آن ها را مشاهده مي کنيد. ساختار جامد کريستالي سديم کلرايد به صورت ج است.
 (ب)
|
(الف) |
(ج)
شکل 1: پيوند يوني سديم کلرايد.
انتقال تنها الکترون 3s اتم سديم به اوربيتال نيمه پر 3p اتم کلر، کاتيون سديم (لايه ي ظرفيت اين يون مثبت،مانند آرايش نئون است) و آنيون کلر (لايه ي ظرفيت اين يون منفي،مانند آرايش آرگون است) توليد مي کند. جاذبه ي الکتروستاتيکي منجر مي شود يون هاي با بارمخالف در يک شبکه ي بلوري (شکل 1- ج) به هم فشرده شده و روي هم انباشته شوند (شکل 2).
نيروهاي جاذبه اي که اين يون ها را در محل خود، متصل به هم نگه مي دارند، مي توانند به عنوان پيوند هاي يوني شناخته شوند.
شکل 2: انباشتگي يون هاي منفي و مثبت کلر و سديم در سديم کلرايد.
پيوند کوالانسي:
در 3 واکنش ديگر معادلات بالا، محصولاتي توليد مي شود که بسيار متفاوت با سديم کلرايد هستند. آب در دماي اتاق، مايع است و دي اکسيدکربن و تترافلوئوريد کربن،گاز هستند. اين ترکيبات از يون تشکيل نشده اند.
يک اندرکنش متفاوت بين اتم ها، پيوند کوالانسي ناميده مي شود که با اشتراک الکترون هاي والانس (ظرفيت) اتم ها به جاي انتقال آشکار الکترون در پيوند يوني، اتفاق مي افتد. شباهت هاي خواص فيزيکي عناصر دو اتمي H2، N2، O2، F2 و Cl2 (همگي به صورت گاز هستند) پيشنهاد مي کند که پيوند کوالانسي هم داشته باشند.
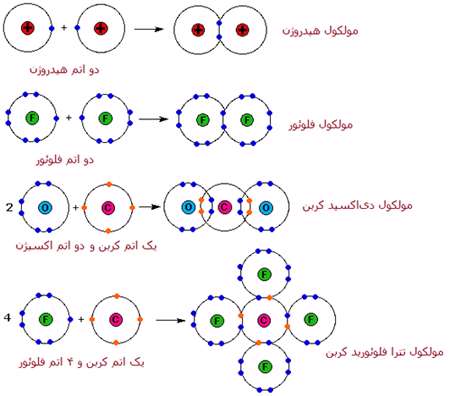
انواع پيوندهاي کوالانسي معادلات بالا
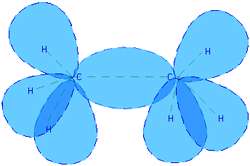
شکل 3: پيوند کوالانسي در مولکول اتان.
لازمه ي پيوند کوالانسي اين است که ترازهاي انرژي يا لايه هاي بيروني تر اتم ها به طور کامل پر نشده باشند تا الکترون هاي اين اتم ها کاملاً بين آن ها به اشتراک گذاشته شوند. در الماس، اتم هاي کربن پيوندهاي کوالانسي با يکديگر تشکيل مي دهند. پيوند کوالانسي، پيوندي بسيار قوي است.
پيوند کوالانسي قطبي:
اين پيوندها بين پيوندهاي يوني و کوالانسي قرار مي گيرند. در اين پيوند، اتم ها الکترون هايشان را به اشتراک مي گذارند اما الکترون ها بيش تر وقت خود را در اطراف اتمي با مقدار الکترونگاتيوي بزرگ تر مي گذرانند. بهترين مثال اين پيوند،
مولکول آب است. اکسيژن بسيار الکترونگاتيوتر از هيدروژن است؛ بنابراين الکترون هاي شرکت کننده در پيوند قطبي آب، بيش تر وقت خود را سمت اکسيژن سپري مي کنند.
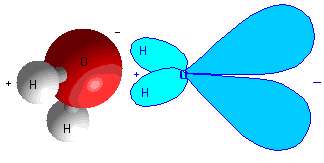
شکل 4: مولکول قطبي آب.
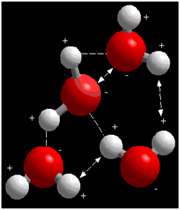 پيوند هيدروژني:
پيوند هيدروژني:

در مولکول آب، اين موضوع که اکسيژن به طور منفي و هيدروژن به طور مثبت باردار شده، به اين معناست که هيدروژن هاي يک مولکول آب، اکسيژن هاي همسايه ي خود را جذب مي کنند و برعکس.
زيرا بار هر دو مخالف هم است. اين جاذبه ي بزرگ الکتروستاتيکي، پيوند هيدروژني ناميده مي شود و در تعيين بسياري از خواص آب نقش دارد. مولکول آب مي تواند اين نوع پيوند را با مولکول هاي قطبي يا يون هاي ديگري مانند هيدروژن يا سديم تشکيل دهد.
علاوه بر اين، پيوندهاي هيدروژني مي توانند درون و بين ديگر مولکول ها نيز اتفاق بيفتند. براي مثال، دو رشته مولکول DNA با پيوند هيدروژني به هم ديگر اتصال پيدا مي کنند.
شکل فوق، گروه کوچکي از مولکول هاي آب را نشان مي دهد. پيوندهاي هيدروژني بين بارهاي مخالف با خط تيره نشان داده شده اند. خطوط پيکان دار دافعه ي بين بارهاي مشابه را نشان مي دهند. تعادل پيوندهاي هيدروژني و نيروهاي دافعه در خواص ويژه ي آب نقش مهمي دارند.
پيوند ديگري که ممکن است وجود داشته باشد، پيوند فلزي است. زماني که الکترون هاي دو اتم فلزي به اشتراک گذاشته شوند، پيوند فلزي تشکيل مي-شود.
مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

